Biophysik der Proteinfaltung
Die Proteinfaltung beschäftigt sich mit der Frage, wie sich die entfaltete Polypeptidkette eines Proteins in die native, biologisch aktive Konformation umwandelt. Hierzu untersuchen wir den entfalteten Zustand und Faltungsintermediate im chemischen Gleichgewicht mit dem nativen Zustand sowie die Umwandlungskinetiken zwischen den einzelnen Zuständen mittels NMR-, Zirkulardichroismus-, und Fluoreszenz-Spektroskopie.
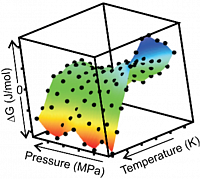
Stabilitätsprofil des Proteins Kti11 in Abhängigkeit der Temperatur und des Drucks, welches mittels NMR-Spektroskopie bestimmt wurde.
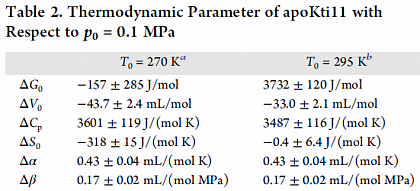
Aus dem Stabilitätsprofil bestimmte thermodynamische Parameter.
Unser besonderes Augenmerk liegt auf der Strukturuntersuchung von transienten Faltungsintermediaten. Im Falle von humanem p19INK4d und dem Gen-3-Protein von fd Phagen konnten wir zeigen, dass diese transienten Zustände eine wichtige Funktion der Proteine darstellen. Der infektiöse Zustand von Gen-3-Protein ist nicht etwa der gefaltete, thermodynamisch stabilste Zustand, sondern ein Faltungsintermediat. Die Inhibition von CDK4/6 im humanen Zellzyklus durch p19INK4d wird über die unterschiedliche Stabilität der einzelner ankyrin repeats geregelt, was wir durch Strukturuntersuchungen transienter Intermediate aufdecken konnten.
Da wir in Lösung arbeiten, können strukturbiologische Untersuchungen von Proteinreaktionen mittels zeitaufgelöster NMR durchgeführt werden.
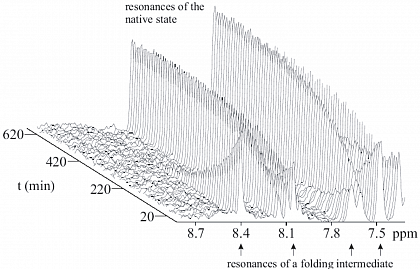
Rückfaltungskinetik eines Faltungsintermediates und des gefalteten Zustandes des Proteins Ribonuklease T1.




