Amyloide Fibrillen (Alzheimer-Peptid, Parathormon)
Die Bildung amyloider Fibrillen tritt bei vielen Krankheiten auf. Für Fibrillen verschiedener Alzheimer-Peptide konnten wir zeigen, dass die Bildung intermolekularer Wasserstoffbrückbindungen eine generische Eigenschaft ist, die andere lokale Interaktionen überschreibt.
Das zu großen Teilen intrinsisch ungefaltete Parathormon aus dem Kalzium- und Phosphatstoffwechsel bildet als Speicherform funktionale amyloide Fibrillen (Abbildung). Hierzu untersuchen wir auch Hybride zwischen Peptid und synthetischen Polymeren, um die physico-chemischen Eigenschaften und den Mechanismus der Fibrillenbildung zu charakterisieren.
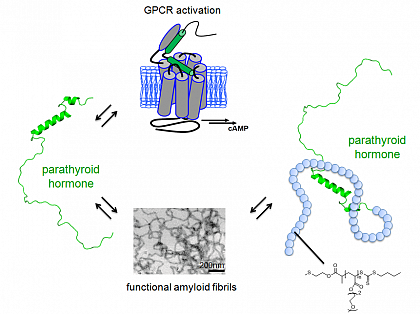
Das zu großen Teilen intrinsisch ungefaltete Parathormon aus dem Kalzium- und Phosphatstoffwechsel bildet als Speicherform funktionale amyloide Fibrillen.

