Dynamik aromatischer Seitenketten in Proteinen
Aromatische Seitenketten kommen überproportional häufig im hydrophoben Kern und in Interaktionsstellen vor. Daher sind sie exzellente Sonden aus erster Hand für dort stattfindende dynamische Vorgänge (Konformations- änderungen).
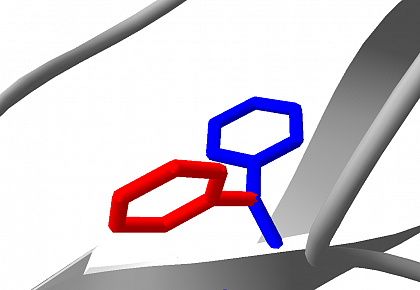
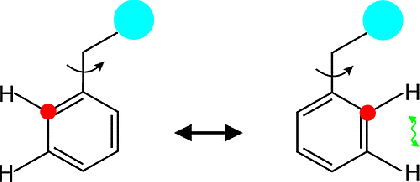
Darüber hinaus untergehen die symmetrischen Ringe von Phenylalanin und Tyrosin kontinuierlich 180° Sprünge um chi-2, sogenannte ring-flips. Über ring-flips lassen sich Aussagen zu transienten "Atmungsprozessen" in Proteinen sowie zur Stärke von aromatischen Interaktionen (aromatic stacking, cation-π) treffen.
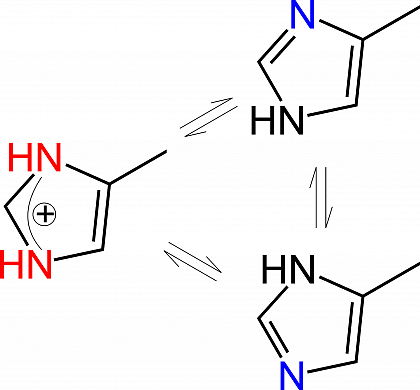
Tyrosin und Histidin tauschen Protonen mit ihrer Umgebung aus. Beide sind daher wichtige katalytische Reste in Säure-Base Katalysen. Histidin ist die wichtigste katalytische Aminosäure. Es kommt in protonierter geladener Form und in 2 neutralen tautomeren Formen vor. So kann es als Protonen "shuttle" fungieren und eine zentrale Rolle im Wasserstoffbrückennetzwerk spielen.