Dynamik von Proteinen
Eine der Stärken der NMR-Spektroskopie sind Dynamikuntersuchungen, die auf einer 15 Größenordnungen überspannenden Zeitskala mit unterschiedlichen Relaxationsmethoden untersucht werden können. Die Funktion der Proteine ist unmittelbar an ihre interne Dynamik gekoppelt, was wir für das Kälteschockprotein CspB, das Metallochaperon SlyD sowie dem humanen Tumorsuppressor p19INK4d zeigen konnten. Wechselwirkungen zwischen Proteinen, wie sie z.B. bei hohen Konzentrationen oder unter molecular crowding Bedingungen auftreten, konnten wir z.B. für die Kristallinproteine der Augenlinse über die Translations- und Rotationsdynamik auflösen.
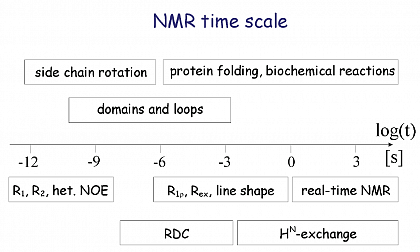
NMR-Zeitskala und korrespondierende Proteindynamiken.

