Forschung
Bei GreenSight konzentriert sich unsere Forschung darauf, das Wachstum und die Physiologie von Algen durch intelligente Sensorik und Datenanalyse zu verstehen. Durch die Kombination von optischen Messungen mit fortschrittlicher Signalverarbeitung und maschinellem Lernen untersuchen wir, wie Umweltbedingungen die Entwicklung der Biomasse im Laufe der Zeit beeinflussen. Dieser Ansatz ermöglicht es uns, aus rohen Sensorsignalen aussagekräftige biologische Erkenntnisse zu gewinnen und so die Wachstumsdynamik, rhythmischen Muster und Stressreaktionen in Algenkulturen aufzudecken.
Sensorgestützter tubularer Photobioreaktor mit regelbarer LED-Beleuchtung

Am Institut für Physik wurde ein tubularer Photobioreaktor in Betrieb genommen, der für die experimentelle Untersuchung von Wachstums- und Stoffwechselprozessen in Mikroalgenkulturen und deren gezielte Optimierung ausgelegt ist. Das System kombiniert eine geschlossene Kulturführung mit einer spektral steuerbaren LED-Beleuchtung und einer umfassenden Sensorik zur in-situ Prozessüberwachung.
Die Anlage erlaubt die kontinuierliche Erfassung physikochemischer und optischer Parameter, darunter:
- Optische Dichte, Streuung und spektrale Absorption (Biomasseentwicklung, Pigmentgehalt)
- Biomasse
- Nitrat- und Phosphatgehalt
- Fluoreszenzsignale zur Quantifizierung der photosynthetischen Effizienz und des Chlorophyllgehalts
- Temperatur- und pH-Wert
- CO₂-Konzentration und Sauerstoffsättigung im Medium
Die LED-Beleuchtung ist sowohl hinsichtlich der spektralen Zusammensetzung als auch der Intensität moduliert steuerbar. Damit können Lichtqualitäten, Lichtgradienten und photoperiodische Zyklen reproduziert werden, wie sie für die Untersuchung von Circadian Rhythmen und lichtabhängigen Stoffwechselprozessen relevant sind. Eine automatisierte Ansteuerung der Beleuchtung erlaubt darüber hinaus gezielte Stimulations- und Adaptationsprotokolle.
Alle Messdaten werden über ein vernetztes Sensorsystem erfasst, in einem offenen Datenformat bereitgestellt und in einer KI-gestützten Analyseumgebung ausgewertet. Hierdurch ist die Korrelation von Kulturparametern mit physiologischen Zustandsgrößen möglich, einschließlich der Modellierung von Wachstumsraten, Pigmentdynamiken und Stoffwechselverschiebungen.

Multispektraler „Mosaik“-Sensorchip zur optischen In-situ-Analyse

Für die kontinuierliche Überwachung von Mikroalgenkulturen wurde zusammen mit Sensoik Technologies GmbH ein multispektrales Sensorsystem entwickelt, das spektral und zeitlich aufgelöste Absorptions-, Streulicht- und Fluoreszenzsignale direkt im Photobioreaktor erfasst. Der sogenannte Mosaik-Sensorchip kombiniert mehrere optische Messprinzipien in einer kompakten, robusten Bauform, die für den Langzeitbetrieb in flüssigen Kultursystemen optimiert ist.
Der Sensor verfügt über:
- 6 integrierte LEDs mit schmalbandigen Emissionsspektren vom UV- bis zum nahen Infrarotbereich (ca. 400–850 nm) zur gezielten spektralen Anregung photosynthetischer Pigmente und Biomassemarker.
- einen 16-Kanal-Hyperspektraldetektor, der die spektrale Antwort der Kultur mit hoher spektraler Auflösung erfasst und sowohl Absorptions- als auch Fluoreszenzsignaturen differenziert auswertbar macht.
- einen 4-Kanal-RGB+IR-Sensor, der die ABsorptions-, Streulicht- und Trübungseigenschaften der Kultur bei definierten Wellenlängen in einem besonders hohen dynamischen Bereich erfasst und damit Aussagen über Zelldichte, Aggregationszustände und Morphologiewechsel erlaubt.
Durch die ratiometrische Auswertung der Messkanäle können Veränderungen in Chlorophyll-a- und Carotinoid -Gehalten, sowie Verschiebungen der photosynthetischen Aktivität bestimmt werden.
Hauptvorteile des Sensorsystems sind:
- In-situ-Messung ohne Probenentnahme
- Keine optischen Fenster → keine Veralgung relevanter Messflächen
- · Direkte Kopplung mit einem digitalen Zwilling des Reaktors
- KI-basierte Zustandserkennung und Prozessregelung
- Hohe zeitliche Auflösung für die Analyse circadianer Dynamiken
- Modular vernetzbar im Photobioreaktor (LoRaWAN/WiFi)
Damit bildet der Mosaik-Sensorchip eine mess- und datentechnische Grundlage für die skalierbare, automatisierte und erklärbare Prozessführung in Photobioreaktoren — sowohl in Forschung als auch industrieller Algenproduktion.

Forschungshighlights 2025
Optische Überwachung des Biomassewachstums

Die Abbildung zeigt den zeitlichen Verlauf der optisch gemessenen Biomasse. Neben den Rohdaten wird eine aus den Messungen abgeleitete geglättete Funktion angezeigt, die den Datenpunkten sehr nahe kommt.
Während des zehntägigen Beobachtungszeitraums steigt die Biomasse um etwa das Fünffache an, wobei jedoch auch vorübergehende Rückgänge zu erkennen sind. Ob es sich dabei um echte biologische Schwankungen oder um Messfehler handelt, muss durch weitere Untersuchungen geklärt werden. Darüber hinaus sind im Signal Schwankungen zu erkennen, die bei der Untersuchung der Ableitung der Kurve deutlicher werden.
Optische Analyse der Wachstumsrate von Biomasse

Die Ableitung der Kurve stellt die zeitliche Veränderung der Biomasse und damit die aktuelle Wachstumsrate dar. Auch hier sind Schwankungen zu erkennen, die jedoch gegen Ende des Beobachtungszeitraums abnehmen. Diese Schwankungen scheinen einem ungefähren Tagesrhythmus zu folgen.
Insgesamt bleibt die Wachstumsrate überwiegend positiv, was mit dem bereits in der vorherigen Abbildung dargestellten allgemeinen Anstieg der Biomasse übereinstimmt.
Zirkadianer Rhythmus beim Wachstum von Biomasse

Um den täglichen Rhythmus der Schwankungen genauer zu untersuchen, zeigt diese Abbildung einen vergrößerten Ausschnitt aus dem vorherigen Diagramm. Die Zeitstempel bestätigen einen Zyklus von etwa 24 Stunden, was mit einem zirkadianen Rhythmus übereinstimmt. Die Daten zeigen auch, dass Algen hauptsächlich nachts wachsen, während das Minimum ihrer Wachstumsphase um die Mittagszeit auftritt.
Zeitaufgelöste Fluoreszenztomographie
Investigators: Franz-Josef Schmitt, Fabian
Rieder
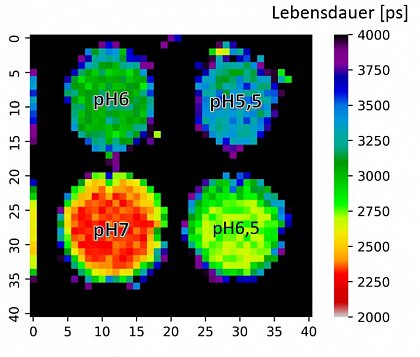
Die Abbildung zeigt die Fluoreszenzlebensdauer in den Vertiefungen einer Mikrotiterplatte als Color-Code, die mit zeitaufgelöster Fluoreszenztomographie und pH-empfindlichen Markermolekülen (Fluoresceinisothiocyanat, FITC) bestimmt wurde.
Die Gruppe untersucht die zeitaufgelöste Fluoreszenztomographie (FT) zur dreidimensionalen Visualisierung fluoreszierender Gewebe mit quantitativer Tiefenempfindlichkeit. Ein Ziel ist die Bestimmung des lokalen pH-Wertes durch die Kombination von zeitaufgelöster Fluoreszenz mit pH-empfindlichen Markermolekülen.
Bei der FT wird das Gewebe angeregt – typischerweise im nahen Infrarotbereich – und die resultierende Emission wird an mehreren Oberflächenpositionen und Betrachtungswinkeln aufgezeichnet. Spezifische Fluoreszenzmarker mit pH-abhängiger Fluoreszenzlebensdauer können verwendet werden, um eine 3D-pH-Karte des Gewebes auf der Grundlage der lokalen Fluoreszenzlebensdauer zu erstellen (siehe Abb.).
Die Fluoreszenzlebensdauer ist weitgehend unabhängig von der Chromophorenkonzentration und wird nur geringfügig durch autofluoreszierende Signale verzerrt, sodass sie einen viel besseren Maßstab für den pH-Wert darstellt als intensitätsbasierte Messungen.
Die Leistung wird anhand von gewebeähnlichen Phantomen und Ex-vivo-Proben bewertet, um die räumliche Auflösung, die Empfindlichkeit, das Kontrast-Rausch-Verhältnis und die absolute Konzentrationsgenauigkeit zu quantifizieren.
Fluoreszierende Moleküle in der Krebsdiagnostik
Investigator: Franz-Josef Schmitt
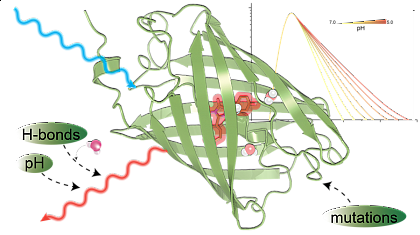
Die Abbildung zeigt, dass gezielte Mutationen fluoreszierende Proteine durch Optimierung der Chromophorstabilisierung, der Chromophor-Wasser-Wechselwirkung und des Protonentransfers im angeregten Zustand für helle Sensoren mit starker pH-Empfindlichkeit verbessern können.
Wir analysieren die pH-Abhängigkeit von rot fluoreszierenden Proteinen, indem wir Breitband-Absorptions-/Emissionsspektroskopie mit mehrkanaliger zeitkorrelierter Einzelphotonen-Zählung (TCSPC) und Decay-Associated-Spectra (DAS)-Analyse koppeln. An die DAS angepasste kinetische Modelle zeigen die pH-Abhängigkeit intramolekularer Relaxationskanäle und helfen, die Wechselwirkung der Moleküle mit Protonen zu verstehen und das spezifische Design optimierter pH-Sensoren zu unterstützen.
Molekulardynamik (MD) bei verschiedenen Protonierungszuständen unterstützt die beobachtete Photophysik und ermöglicht ein Verständnis der Rolle spezifischer Aminosäuren bei der Stabilisierung des Chromophors und der Modulation der Effizienz des Protonentransfers im angeregten Zustand (ESPT), wodurch eine mechanistische Grundlage für pH-sensitive Lebensdauer- und Intensitätsmessungen geschaffen wird.
Insgesamt ermöglicht die Verbindung von MD und Spektroskopie das Verständnis der intramolekularen Wasser-/Chromophor-Dynamik bei ESPT und ermöglicht spezifisches Design von pH-Biosensoren aus rot fluoreszierendem Protein. Lebensdauerbasierte Fluoreszenz, hochauflösender/ultraschnelle Fluoreszenzmikroskopie und Pump-Probe-Photoakustik können dann von diesen Biosensoren als Marker profitieren (siehe Abb.).




