Projekte
Hybridmodelle und Inversionsmethoden für die quantitative photoakustische Tomographie (DFG-SBH, LA3273/7-1)
Die biomedizinische photoakustische (PA) Tomographie beruht auf der Erzeugung von Ultraschall im Gewebe durch die Absorption von intensitätsmoduliertem Licht. Aufgrund der dominanten Absorption von Hämoglobin im sichtbaren und nahinfraroten Spektralbereich können so hochaufgelöste 3D-Bilder der Gefäßnetzwerke im Weichgewebe erfasst werden. Zugleich bietet der PA Effekt einen Kontrast für die Detektion exogener oder genetisch exprimierter Kontrastmittel. Ein großes Potential dieser Technologie liegt in der Fähigkeit, 3D-Bilder von absoluten Chromophorkonzentrationen (z.B. Oxy-und Desoxyhämoglobin, Kontrastmittel) sowie davon abgeleiteter funktioneller Parameter, wie der Blutsauerstoffsättigung, in hoher räumlicher Auflösung zu bestimmen. Die Entwicklung von Methoden für die quantitative PA Tomographie ist für die Translation zu Routineanwendungen in der funktionellen und molekularen Bildgebung von entscheidender Bedeutung. In diesem Projekt werden umfassende Vorwärtsmodelle entwickelt, um multispektrale PA Bilder zu simulieren, die in hoher Übereinstimmung zu realen und mit arbiträren Tomographen erfassten Bildern stehen. Die Modelle werden in adjungierter Form in Inversionsalgorithmen verwendet und auf Basis neuartiger experimenteller Methoden an Bildern von Gewebephantomen experimentell validiert. Die Limitationen der neuen Methoden werden in silico evaluiert. Perspektivisch sollen die hier entwickelten Modelle die quantitative PA Tomographie sowohl mittels modellbasierter als auch datengesteuerter Inversionen ermöglichen. Eine erfolgreiche Entwicklung der Modelle und Methoden wird die Grundlage für eine schnelle Verbreitung der funktionellen und molekularen PA Bildgebung in der Biologie, den Lebenswissenschaften und der Medizin schaffen.
Hochempfindliche Fabry-Pérot Ultraschallsensoren für die parallelisierte photoakustische Signaldetektion
Das Ziel des Projekts ist eine Erhöhung der akustischen Empfindlichkeit optischer Ultraschalldetektoren, die auf dem Fabry-Pérot-Interferometer beruhend, und die Parallelisierung dieser Bildgebertechnologie. Dies wird Aufnahmen mit hoher Bildrate ermöglichen, mit denen schnelle physiologische Prozesse verfolgt werden können. In Kooperation mit der TH Wildau werden abstimmbare Fabry-Pérot Ultraschallsensoren entwickelt, um eine hochparallelisierte Signalerfassung, und somit eine um Größenordnungen schnellere Bildaufnahme, zu ermöglichen.
Genetisch exprimierte Reporterproteine und Chromophoren für die photoakustische Bildgebung
Um normalerweise transparente Säugetierzellen, wie z.B. Stammzellen oder Tumorzellen, in tiefem Gewebe mittels photoakustischer Tomographie (PAT) zu detektieren, wird oftmals die Methode der genetischen Exprimierung von Reporterproteinen oder pigment-produzierenden Enzymen genutzt. Fluoreszente Proteine sind nicht für PAT geeignet, da sie bleichen und relativ geringe photoakustische Signalamplituden erzeugen.
Um diese Limitationen zu überwinden, wird die Entwicklung photo-schaltbarer Proteine (Phytochrome) vorangetrieben, deren erfolgreiche in vivo Detektion trotz des starken Hintergundkontrasts durch Haemoglobin wir vor kurzem demonstrieren konnten.
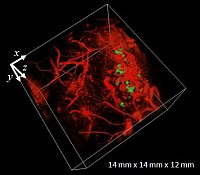
Photoakustisches Bild der Vaskulatur eines subkutanen Tumors und der umliegenden Haut. Die Tumorzellen exprimieren ein photoschaltbares Protein (grün), dessen räumliche Verteilung durch photoakustische Differenzbildgebung bestimmt wurde.
Photoakustische Tomographie fluoreszierender Kontrastmittel mittels Pump-Probe-Anregung (DFG-SBH LA3473/8-1)
Die biomedizinische photoakustische (PA) Tomographie beruht auf der Erzeugung von Ultraschall im Gewebe durch die Absorption von intensitätsmoduliertem Licht. Aufgrund der dominanten Absorption von Hämoglobin im sichtbaren und nahinfraroten Spektralbereich können so hochaufgelöste 3D-Bilder der Gefäßnetzwerke im Weichgewebe erfasst werden. Zugleich bietet der PA Effekt einen Kontrast für die Detektion exogener Kontrastmittel. Derzeitige experimentelle und rechnergestützte Methoden zur Bestimmung der räumlichen Kontrastmittelverteilung aus PA-Bildern sind in ihrer Sensitivität, Spezifität und Allgemeingültigkeit limitiert. In diesem Projekt sollen neuartige experimentelle Ansätze zur Detektion von Fluorophoren mittels Pump-Probe-Anregung entwickelt und mit präzisen numerischen Methoden der quantitativen PA-Tomographie verknüpft werden, um so eine Vielzahl neuer Anwendungsmöglichkeiten in der multiplexen PA-Bildgebung biophysikalischer und biochemischer Parameter zu eröffnen.
Repotermoleküle für genetichen Kontrast in der molekularen photoakustischen Tomographie - ESF Projekt
The photoacoustic (PA) effect, the conversion of intensity-modulated light into sound, has found application in diverse areas, such as the material sciences, spectroscopy, and deep tissue imaging. It relies on the absorption of optical energy by tissue chromophores, such as haemoglobin, melanin, lipid to generate broadband ultrasound waves that are detected outside the organism and avoids the ionising radiation of x-ray computed tomography to allow longitudinal studies in the same organism without side effects. By exploiting the wavelength-dependence of the optical absorption of oxy- and deoxyhaemoglobin, functional and metabolic imaging has been demonstrated while the use of exogenous and genetically expressed probes has added to molecular imaging capabilities. Genetically expressed proteins and pigment-synthesising enzymes are an attractive approach to produce PA contrasts (e.g. via a photoswitchable phytochromes as shown in Figure 1), and it offers the potential to spy on cells and tumours using PA tomography. To date, comparatively few genetic reporters have been imaged successfully in mammals and their tumour-selective expression in vivo has not been demonstrated.
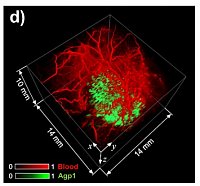
Figure 1. In vivo PA tomography of genetically expressed
photoswitchable phytochrome (Agp1) using a Fabry-Pérot-
based scanner. 3D image of a subcutaneous tumour expressing
a Agp1 (green) and the vasculature (red) of the surrounding
tissue.
The objective of th of this ESF-funded project is the development of genetically expressed molecular PA reporters in tumour cells to allow their detection in vivo. It is envisaged that features in the aquired image data sets will allow a correlation of cellular activity with physiological function in deep tissue solid tumours. The Medical Physics research group will design and generate a tumour-specific expression pattern of PA reporters in mammalian cells. Functionalised expression of the PA reporter proteins in malignant tumours will be validated by molecular techniques. Finally, PA tomography is applied to detect tumour-specific PA reporters and produce 3D PA images of tumours in vivo.
The technologies and methods developed in this project will provide novel materials and methods for non-invasive PA reporter gene imaging. It has the potential to enable in vivo studies of the molecular and cellular processes controlling disease progression and to correlate cellular activity with physiological function and anatomical changes. It will have a major impact on a wide range of research fields in the life sciences, biology, and medicine, such as oncology, neurology, and immunology, with applications ranging from basic research to clinical studies.
Project duration: 01.10.2020 - 31.05.2022
Contact: Prof. Dr. Jan Laufer and Dr. Amna Shah Mehmood
Telephone: 0345 55 25400/7
E-mail: jan.laufer@physik.uni-halle.de, amna.mehmood@physik.uni-halle.de


